Sintesis Ester Malonat
Sintesis ester
malonat merupakan salah satu reaksi alkilasi karbonil yang
terkenal dan tertua dan merupakan metoda yang
bagus untuk membuat asam
asetat
yang tersubstitusi α dari alkil halida.
Secara umum,
produk reaksi dari ester malonat atau ester asetoasetat adalah
asam-asam asetat tersubtitusi atau aseton tersubtitusi (Feassenden,
1982:171). Menurut Clayden sebagaimana dikutip oleh Firdaus et al,
(2013) berdasarkan struktur kimia dari etil asetoasetat, diketahui bahwa
senyawa ini memiliki posisi dua hydrogen α, yaitu hydrogen α yang
bertetangga dengan gugus karbonil keto serta hydrogen α yang diapit oleh
dua gugus karbonil. Keasaman kedua posisi hidrogen –α ini berbeda,
dimana hidrogen –α yang diapit oleh dua gugus karbonil bersifat lebih
asam (pKa =11) dibandingkan yang hanya bertetangga dengan karbonil
keto (pKa>20). Hal ini disebabkan terjadinya kestabilan anion
melalui delokalisasi elektron pada kedua oksigen karbonil. Oleh
karena itu, pembentukan ion enolat terjadi melalui pelepasan
hidrogen –α yang diapit oleh dua gugus karbonil tersebut (Fauziyah,
2015). Senyawa karbonil mempunyai keasaman yang jauh lebih besar
daripada analog hidrokarbonnya. Hal ini disebabkan oleh kemampuan gugus
karbonil untuk mengawas tempatkan muatan negative basa konjugasinya
(Pine, 1988:304).
Pembentukan
ion enolat dari reaksi antara etil asetoasetat dan natrium dalam etanol
kering. Pelarut etanol yang digunakan haruslah bebas dari air agar tidak
bereaksi dengan natrium etoksida membentuk natrium hidroksida (Firdaus,
2013). Reaksi alkilasi tidak terbatas hanya pada enolat dari dietil
malonat. Enolat lain juga menjalani reaksi SN2 dengan alkil halide untuk
menghasilkan produk teralkilasi. Enolat lain yang lazim digunakan
adalah enolat yang diperoleh dari etil asetoasetat (ester asetoasetat).
Produk akhir alkilasi ester asetoasetat adalah aseton tersubtitusi α
(Feassenden, 1982:170). Jadi, sebelum mengalami tahap selanjutnya dari
sintesis ester asetoasetat, senyawa ester asetoasetat ini terlebih
dahulu diubah menjadi anion enolat oleh perlakuan natrium etoksida, yang
kemudian ion enolatnya akan dialkilasi melalui reaksi SN2 dengan alkil
halide. Pada proses alkilasi ini dapat dilakukan dua kali jika
diinginkan, hal ini dikarenakan ester asetoasetat memilki dua hydrogen
α.
Tahap-tahap dalam suatu sintesis ester asetoasetat mirip dengan tahap-tahap sintesis ester malonat, yaitu sebagai berikut:
- Pembuatan enolat

- Alkilasi

- Hidrolisis dan Dekarboksilasi

(Feassenden, 1982:170-171).
Jadi, dapat
disimpulkan hasil sintesis dari senyawa ester asetoasetat akan
menghasilkan suatu aseton tersubtitusi α. Untuk mendapatkan senyawa
aseton tersubtitusi tersebut dapat dilakukan melalui beberapa tahap.
Tahap sintesis ester asetoasetat tersebut dilakuan dengan mengubah
senyawa ester asetoasetat menjadi ion enolat dengan penambahan natrium
etoksida, yang kemudian dialkilasi melalui reaksi SN2 dengan alkil
halide primer dan dihidrolisis serta didekarboksilasi.
Contoh: Sintesis 3-metil-2-heksanon
Sintesis 3-metil-2-heksanon

Alkilasi (Bahasa Inggris: alkylation) atauGugus alkil merupakan
gugus univalen yang diperoleh dari alkana yang telah diambil satu atom
hidrogen. Dalam Literatur lain, Alkilasi merupakan penambahan jumlah
atom dalam molekul menjadi molekul yang lebih panjang dan bercabang.
Dalam proses ini menggunakan katalis asam kuat sepertiH2SO4, HCl, AlCl3 (Asam kuat Lewis). Reaksi secara umum adalah sebagai berikut:
RH + CH2=CR’R’’ ---------> R-CH2-CHR’R”
Salah
satu reaksi yang paling penting dari enolat adalah alkilasi oleh adanya
perlakuan dengan alkil halida. Reaksi ini sangat berguna untuk tujuan
sintesis karena memungkinkan pembentukan ikatan karbon-karbon baru,
yaitu menggabungkan dua senyawa yang lebih kecil menjadi molekul yang
lebih besar. Alkilasi terjadi bila anion enolat yang nukleofilik
bereaksi dengan alkil halida yang elektrofilik dan memaksa keluar
‘leaving group’ melalui mekanisme SN2. Reaksi dapat terjadi pada atom
oksigen enolat atau karbon alfa, tetapi secara normal terjadi pada atom
karbon.
Kedua sintesis yang dibahas dalam bagian ini menyediakan rute ke berbagai macam asam karboksilat dan metil keton. Anda mungkin ingin meninjau faktor-faktor yang mempengaruhi reaksi SN 2 (Bagian 11.3) dalam hubungannya dengan bagian ini.
Anda harus mencoba untuk menghafal struktur ester malonik dan etil asetoasetat. Nama IUPAC dari senyawa ini ditunjukkan pada tabel di bawah ini.
| Struktur | Nama yang umum | Nama IUPAC |
|---|---|---|
 | asam malonat | asam propanedioic |
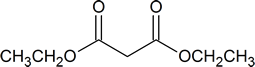 | ester malonis atau dietil malonat | dietil propanedioate |
 | asam acetoacetic | Asam 3-oksobutanoat |
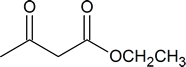 | etil asetoasetat atau ester acetoacetic | etil 3 ‑ oxobutanoate |
Enolat dapat bertindak sebagai nukleofil dalam reaksi tipe S N 2. Keseluruhan hidrogen α diganti dengan gugus alkil. Reaksi ini adalah salah satu yang lebih penting untuk enolat karena ikatan karbon-karbon terbentuk. Alkilasi ini dipengaruhi oleh keterbatasan yang sama seperti reaksi S N 2 yang telah dibahas sebelumnya. Kelompok meninggalkan yang baik, X = klorida, bromida, iodida, tosilat, harus digunakan.Juga,
kelompok cuti sekunder dan tersier tidak boleh digunakan karena
reaktivitas yang buruk dan kemungkinan persaingan dengan reaksi
eliminasi.Terakhir, penting untuk menggunakan basa kuat, seperti LDA atau natrium amida, untuk reaksi ini.Menggunakan basis yang lebih lemah seperti hidroksida atau alkoksida meninggalkan kemungkinan terjadinya beberapa alkilasi.
Sintesis Ester Malotis
Malon ester adalah reagen khusus yang
digunakan dalam reaksi yang mengubah alkil halida menjadi asam
karboksilat yang disebut Sintesis Ester Malotis.Sintesis
ester malonik adalah prosedur sintetik yang digunakan untuk mengubah
senyawa yang memiliki rumus struktur umum 1 menjadi asam karboksilat
yang memiliki rumus struktur umum 2.

Karena kenyataan bahwa α hidrogen Malonic
ester berdekatan dengan dua karbonil, mereka dapat dideprotonasi oleh
natrium etoksida (NaOEt) untuk membentuk Sodio Malonic Ester.

Karena Sodio Malonic Ester adalah enolate, maka dapat dialkilasi dengan alkil halida.
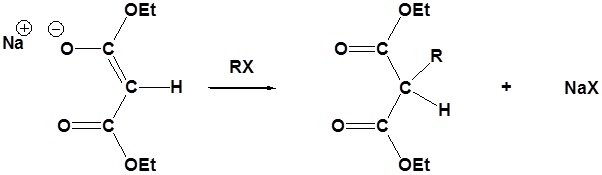
Setelah alkilasi produk dapat diubah menjadi
asam dikarboksilat melalui saponifikasi dan selanjutnya salah satu asam
karboksilat dapat dihilangkan melalui langkah dekarboksilasi.
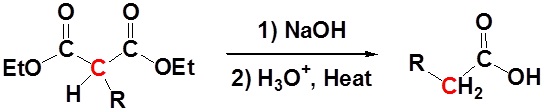
Mekanisme
1) Saponifikasi
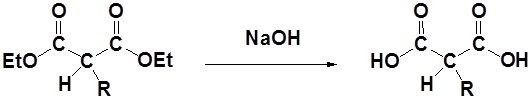
2) Dekarboksilasi
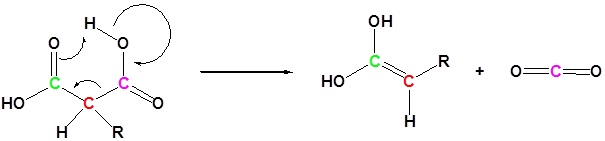
3) Tautomerisasi

Semua langkah bersama membentuk sintesis ester Malison.
\ [RX \ rightarrow RCH_2CO_2H \]
Contoh
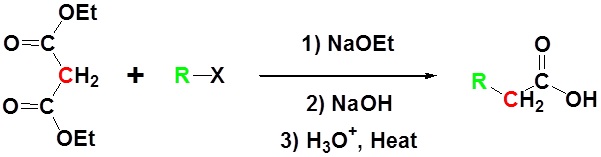
Sintesis Ester Acetoacetic
Sintesis ester asetasetetik memungkinkan
konversi etil asetoasetat menjadi metil keton dengan satu atau dua gugus
alkil pada karbon alfa.
Tangga
1) Deprotonasi dengan etoksida
2) Reaksi Alkilasi melalui dan SN2
3) Hidrolisis dan dekarboksilasi
Selain kelompok alky kedua
Setelah langkah pertama dan gugus alkil tambahan dapat ditambahkan sebelum tahap dekarboksilasi.Secara keseluruhan ini memungkinkan untuk penambahan dua gugus alkil yang berbeda.
Alkilasi langsung
Sintesis ester malonik dan sintesis ester
asetoasetat dapat dibentuk sebelumnya dengan basa yang relatif ringan,
seperti natrium etoksida, karena sifat asam yang luar biasa dari senyawa
dikarbonil. Namun, jika pangkalan yang lebih kuat digunakan, seperti LDA, senyawa monocarbonyl juga dapat dialkilasi dalam posisi alfa.
CONTOH 22.7.1: ALFA ALKILASI
Mekanisme
1) Enolate formasi
2) Serangan S N 2
Enol (juga disebut sebagai alkenol) adalah alkena yang mempunyai gugus hidroksil yang melekat pada karbon berikatan rangkap dua. Enol dan senyawa karbonil (seperti keton dan aldehida) sebenarnya adalah isomer; ini dikenal sebagai tautomerisme keto-enol:
Bentuk enol ditunjukkan pada gambar sebelah kanan. Biasanya ia tidak stabil dan berubah dengan cepat menjadi bentuk keto (keton) pada gambar sebelah kiri. Hal ini dikarenakan oksigen lebih elektronegatif daripada karbon, sehingga oksigen membentuk energi ikatan rangkap yang lebih kuat. Ikatan ganda karbon-oksigen (karbonil) lebih kuat dua kali lipat daripada ikatan tunggal karbon-oksigen, namun ikatan ganda karbon-karbon lebih lemah daripada dua ikatan tunggal karbon-karbon.
Hanya dalam senyawa 1,3-dkarbonil dan 1,3,5-trikarbonil yang memiliki bentuk enol yang stabil. Hal ini disebabkan oleh resonansi dan ikatan hidrogen antarmolekul yang terjadi pada bentuk enol dan tidak mungkin terjadi pada bentuk keto. Oleh karenanya, pada kesetimbangan, lebih dari 99% molekul propanadial (OHCCH2CHO) berbentuk monoenol. Persentase tersebut lebih rendah untuk keton 1,3-aldehida dan diketon. Enol (dan enolat) merupakan zat antara yang penting pada banyak reaksi organik.
Perkataan enol dan alkenol adalah akronim dari alkena (-ena) dan alkohol (-ol).
Ion enolat
Ketika gugus hidroksil (−OH) pada sebuah enol melepaskan ion hidrogen (H+), akan terbentuk enolat yang bermuatan negatif:Senyawa 1,3-dikarbonil dan 1,3,5-trikarbonil sedikit asam karena adanya stabilisasi resonansi yang kuat yang terjadi ketika satu atom hidrogen dilepaskan (dari bentuk keto maupun enol). Resonansi enol memiliki analogi yang sama yang digunakan untuk menjelaskan keasaman fenol, yakni terjadi delokalisasi muatan negatif ion enolat ke karbon alfa. Ion-ion enolat ini sangatlah berguna dalam sintesis senyawa alkohol dan karbonil yang rumit. Ia sangat berguna karena karbon-α gugus enolat bersifat nukleofilik.
Pada keton (sejenis karbonil) dengan hidrogen-α yang asam pada kedua karbon di sebelah gugus karbonil, selektivitas deprotonasi dapat dicapai untuk mendapatkan enolat yang kita inginkan. Pada temperatur rendah (-78 °C, yakni dengan penangas es kering), pelarut aprotik, dan basa seperti LDA, proton "kinetik" dapat dilepaskan. Proton "kinetik" adalah proton yang secara sterik lebih mudah dijangkau. Di bawah kondisi termodinamik (temperatur yang lebih hangat, basa lemah, dan pelarut protik), kesetimbangan terjadi antara keton dengan dua enolat yang memungkinkan. Enolat yang difavoritkan diistilahkan sebagai enolat "termodinamik" dan difavoritkan karena ia memiliki aras energi yang lebih rendah dari enolat yang dimungkinkan lainnya.
Permasalahan:
2. Pembentukan ion enolat dari reaksi antara etil asetoasetat dan natrium dalam etanol kering. Pelarut etanol yang digunakan haruslah bebas dari air. mengapa demikian ?
3.Enol (juga disebut sebagai alkenol) adalah alkena yang mempunyai gugus hidroksil yang melekat pada karbon berikatan rangkap dua. Enol dan senyawa karbonil (seperti keton dan aldehida) sebenarnya adalah isomer; ini dikenal sebagai tautomerisme keto-enol: Biasanya ia tidak stabil dan berubah dengan cepat menjadi bentuk keto (keton). Apahal yang menyebabkan tidak stabilnya senyawa yang terbentuk tersebut sehingga ia akan berubah dengan cepat menjadi bentuk keton?



Saya akan mencoba menjawab permasalahn no 3 .Hal ini dikarenakan oksigen lebih elektronegatif daripada karbon, sehingga oksigen membentuk energi ikatan rangkap yang lebih kuat. Ikatan ganda karbon-oksigen (karbonil) lebih kuat dua kali lipat daripada ikatan tunggal karbon-oksigen, namun ikatan ganda karbon-karbon lebih lemah daripada dua ikatan tunggal karbon-karbon. .(Wikipedia bahasa Indonesia, ensiklopedia bebas)
ReplyDeleteHanya dalam senyawa 1,3-dkarbonil dan 1,3,5-trikarbonil yang memiliki bentuk enol yang stabil. Hal ini disebabkan oleh resonansi dan ikatan hidrogen antarmolekul yang terjadi pada bentuk enol dan tidak mungkin terjadi pada bentuk keto. Oleh karenanya, pada kesetimbangan, lebih dari 99% molekul propanadial (OHCCH2CHO) berbentuk monoenol. Persentase tersebut lebih rendah untuk keton 1,3-aldehida dan diketon. Enol (dan enolat) merupakan zat antara yang penting pada banyak reaksi organik.
Saya akan jawab no 3.
ReplyDeleteEnol (juga disebut sebagai alkenol) adalah alkena yang mempunyai gugus hidroksil yang melekat pada karbon berikatan rangkap dua. Enol dan senyawa karbonil (seperti keton dan aldehida) sebenarnya adalah isomer; ini dikenal sebagai tautomerisme keto-enol:
Enol.png
Bentuk enol ditunjukkan pada gambar sebelah kanan. Biasanya ia tidak stabil dan berubah dengan cepat menjadi bentuk keto (keton) pada gambar sebelah kiri. Hal ini dikarenakan oksigen lebih elektronegatif daripada karbon, sehingga oksigen membentuk energi ikatan rangkap yang lebih kuat. Ikatan ganda karbon-oksigen (karbonil) lebih kuat dua kali lipat daripada ikatan tunggal karbon-oksigen, namun ikatan ganda karbon-karbon lebih lemah daripada dua ikatan tunggal karbon-karbon.
Hanya dalam senyawa 1,3-dkarbonil dan 1,3,5-trikarbonil yang memiliki bentuk enol yang stabil. Hal ini disebabkan oleh resonansi dan ikatan hidrogen antarmolekul yang terjadi pada bentuk enol dan tidak mungkin terjadi pada bentuk keto. Oleh karenanya, pada kesetimbangan, lebih dari 99% molekul propanadial (OHCCH2CHO) berbentuk monoenol. Persentase tersebut lebih rendah untuk keton 1,3-aldehida dan diketon. Enol (dan enolat) merupakan zat antara yang penting pada banyak reaksi organik.
Perkataan enol dan alkenol adalah akronim dari alkena (-ena) dan alkohol (-ol).
Ion enolat
Ketika gugus hidroksil (−OH) pada sebuah enol melepaskan ion hidrogen (H+), akan terbentuk enolat yang bermuatan negatif:
Formation of Enolate.PNG
Enolat hanya akan terdapat pada kondisi yang bebas asam Brønsted karena secara umum enolat bersifat sangat basa.
Senyawa 1,3-dikarbonil dan 1,3,5-trikarbonil sedikit asam karena adanya stabilisasi resonansi yang kuat yang terjadi ketika satu atom hidrogen dilepaskan (dari bentuk keto maupun enol). Resonansi enol memiliki analogi yang sama yang digunakan untuk menjelaskan keasaman fenol, yakni terjadi delokalisasi muatan negatif ion enolat ke karbon alfa. Ion-ion enolat ini sangatlah berguna dalam sintesis senyawa alkohol dan karbonil yang rumit. Ia sangat berguna karena karbon-α gugus enolat bersifat nukleofilik.
Pada keton (sejenis karbonil) dengan hidrogen-α yang asam pada kedua karbon di sebelah gugus karbonil, selektivitas deprotonasi dapat dicapai untuk mendapatkan enolat yang kita inginkan. Pada temperatur rendah (-78 °C, yakni dengan penangas es kering), pelarut aprotik, dan basa seperti LDA, proton "kinetik" dapat dilepaskan. Proton "kinetik" adalah proton yang secara sterik lebih mudah dijangkau. Di bawah kondisi termodinamik (temperatur yang lebih hangat, basa lemah, dan pelarut protik), kesetimbangan terjadi antara keton dengan dua enolat yang memungkinkan. Enolat yang difavoritkan diistilahkan sebagai enolat "termodinamik" dan difavoritkan karena ia memiliki aras energi yang lebih rendah dari enolat yang dimungkinkan lainnya.
Saya akan mejawab no 2 Pembentukan ion enolat dari reaksi antara etil asetoasetat dan natrium dalam etanol kering. Pelarut etanol yang digunakan haruslah bebas dari air agar tidak bereaksi dengan natrium etoksida membentuk natrium hidroksida (Firdaus, 2013). Reaksi alkilasi tidak terbatas hanya pada enolat dari dietil malonat. Enolat lain juga menjalani reaksi SN2 dengan alkil halide untuk menghasilkan produk teralkilasi. Enolat lain yang lazim digunakan adalah enolat yang diperoleh dari etil asetoasetat (ester asetoasetat). Produk akhir alkilasi ester asetoasetat adalah aseton tersubtitusi α (Feassenden, 1982:170). Jadi, sebelum mengalami tahap selanjutnya dari sintesis ester asetoasetat, senyawa ester asetoasetat ini terlebih dahulu diubah menjadi anion enolat oleh perlakuan natrium etoksida, yang kemudian ion enolatnya akan dialkilasi melalui reaksi SN2 dengan alkil halide. Pada proses alkilasi ini dapat dilakukan dua kali jika diinginkan, hal ini dikarenakan ester asetoasetat memilki dua hydrogen α.
ReplyDeleteSaya akan jawab no 3.
ReplyDeleteEnol (juga disebut sebagai alkenol) adalah alkena yang mempunyai gugus hidroksil yang melekat pada karbon berikatan rangkap dua. Enol dan senyawa karbonil (seperti keton dan aldehida) sebenarnya adalah isomer; ini dikenal sebagai tautomerisme keto-enol:
Enol.png
Bentuk enol ditunjukkan pada gambar sebelah kanan. Biasanya ia tidak stabil dan berubah dengan cepat menjadi bentuk keto (keton) pada gambar sebelah kiri. Hal ini dikarenakan oksigen lebih elektronegatif daripada karbon, sehingga oksigen membentuk energi ikatan rangkap yang lebih kuat. Ikatan ganda karbon-oksigen (karbonil) lebih kuat dua kali lipat daripada ikatan tunggal karbon-oksigen, namun ikatan ganda karbon-karbon lebih lemah daripada dua ikatan tunggal karbon-karbon.
Saya akan mencoba menjawab permasalahan yang ke 3 Senyawa 1,3-dikarbonil dan 1,3,5-trikarbonil sedikit asam karena adanya stabilisasi resonansi yang kuat yang terjadi ketika satu atom hidrogen dilepaskan (dari bentuk keto maupun enol). Resonansi enol memiliki analogi yang sama yang digunakan untuk menjelaskan keasaman fenol, yakni terjadi delokalisasi muatan negatif ion enolat ke karbon alfa. Ion-ion enolat ini sangatlah berguna dalam sintesis senyawa alkohol dan karbonil yang rumit. Ia sangat berguna karena karbon-α gugus enolat bersifat nukleofilik.
ReplyDeletePada keton (sejenis karbonil) dengan hidrogen-α yang asam pada kedua karbon di sebelah gugus karbonil, selektivitas deprotonasi dapat dicapai untuk mendapatkan enolat yang kita inginkan. Pada temperatur rendah (-78 °C, yakni dengan penangas es kering), pelarut aprotik, dan basa seperti LDA, proton "kinetik" dapat dilepaskan.
Saya akan menjawab permasalahan no 1. Salah satu reaksi yang paling penting dari enolat adalah alkilasi oleh adanya perlakuan dengan alkil halida. Reaksi ini sangat berguna untuk tujuan sintesis karena memungkinkan pembentukan ikatan karbon-karbon baru, yaitu menggabungkan dua senyawa yang lebih kecil menjadi molekul yang lebih besar. Alkilasi terjadi bila anion enolat yang nukleofilik bereaksi dengan alkil halida yang elektrofilik dan memaksa keluar ‘leaving group’ melalui mekanisme SN2. Reaksi dapat terjadi pada atom oksigen enolat atau karbon alfa, tetapi secara normal terjadi pada atom karbon.
ReplyDeleteSaya akan mejawab no 2 Pembentukan ion enolat dari reaksi antara etil asetoasetat dan natrium dalam etanol kering. Pelarut etanol yang digunakan haruslah bebas dari air agar tidak bereaksi dengan natrium etoksida membentuk natrium hidroksida (Firdaus, 2013). Reaksi alkilasi tidak terbatas hanya pada enolat dari dietil malonat. Enolat lain juga menjalani reaksi SN2 dengan alkil halide untuk menghasilkan produk teralkilasi. Enolat lain yang lazim digunakan adalah enolat yang diperoleh dari etil asetoasetat (ester asetoasetat). Produk akhir alkilasi ester asetoasetat adalah aseton tersubtitusi α (Feassenden, 1982:170). Jadi, sebelum mengalami tahap selanjutnya dari sintesis ester asetoasetat, senyawa ester asetoasetat ini terlebih dahulu diubah menjadi anion enolat oleh perlakuan natrium etoksida, yang kemudian ion enolatnya akan dialkilasi melalui reaksi SN2 dengan alkil halide. Pada proses alkilasi ini dapat dilakukan dua kali jika diinginkan, hal ini dikarenakan ester asetoasetat memilki dua hydrogen α.
ReplyDeleteAlkilasi (Bahasa Inggris: alkylation) atauGugus alkil merupakan gugus univalen yang diperoleh dari alkana yang telah diambil satu atom hidrogen. Dalam Literatur lain, Alkilasi merupakan penambahan jumlah atom dalam molekul menjadi molekul yang lebih panjang dan bercabang. Dalam proses ini menggunakan katalis asam kuat sepertiH2SO4, HCl, AlCl3 (Asam kuat Lewis). Reaksi secara umum adalah sebagai berikut:
ReplyDeleteRH + CH2=CR’R’’ ---------> R-CH2-CHR’R”
Salah satu reaksi yang paling penting dari enolat adalah alkilasi oleh adanya perlakuan dengan alkil halida. Reaksi ini sangat berguna untuk tujuan sintesis karena memungkinkan pembentukan ikatan karbon-karbon baru, yaitu menggabungkan dua senyawa yang lebih kecil menjadi molekul yang lebih besar. Alkilasi terjadi bila anion enolat yang nukleofilik bereaksi dengan alkil halida yang elektrofilik dan memaksa keluar ‘leaving group’ melalui mekanisme SN2. Reaksi dapat terjadi pada atom oksigen enolat atau karbon alfa, tetapi secara normal terjadi pada atom karbon.
Saya akan mejawab no 2 Pembentukan ion enolat dari reaksi antara etil asetoasetat dan natrium dalam etanol kering. Pelarut etanol yang digunakan haruslah bebas dari air agar tidak bereaksi dengan natrium etoksida membentuk natrium hidroksida (Firdaus, 2013). Reaksi alkilasi tidak terbatas hanya pada enolat dari dietil malonat. Enolat lain juga menjalani reaksi SN2 dengan alkil halide untuk menghasilkan produk teralkilasi. Enolat lain yang lazim digunakan adalah enolat yang diperoleh dari etil asetoasetat (ester asetoasetat). Produk akhir alkilasi ester asetoasetat adalah aseton tersubtitusi α (Feassenden, 1982:170). Jadi, sebelum mengalami tahap selanjutnya dari sintesis ester asetoasetat, senyawa ester asetoasetat ini terlebih dahulu diubah menjadi anion enolat oleh perlakuan natrium etoksida, yang kemudian ion enolatnya akan dialkilasi melalui reaksi SN2 dengan alkil halide. Pada proses alkilasi ini dapat dilakukan dua kali jika diinginkan, hal ini dikarenakan ester asetoasetat memilki dua hydrogen α.
ReplyDeleteSaya akan jawab no 3.
ReplyDeleteEnol (juga disebut sebagai alkenol) adalah alkena yang mempunyai gugus hidroksil yang melekat pada karbon berikatan rangkap dua. Enol dan senyawa karbonil (seperti keton dan aldehida) sebenarnya adalah isomer; ini dikenal sebagai tautomerisme keto-enol:
Enol.png
Bentuk enol ditunjukkan pada gambar sebelah kanan. Biasanya ia tidak stabil dan berubah dengan cepat menjadi bentuk keto (keton) pada gambar sebelah kiri. Hal ini dikarenakan oksigen lebih elektronegatif daripada karbon, sehingga oksigen membentuk energi ikatan rangkap yang lebih kuat. Ikatan ganda karbon-oksigen (karbonil) lebih kuat dua kali lipat daripada ikatan tunggal karbon-oksigen, namun ikatan ganda karbon-karbon lebih lemah daripada dua ikatan tunggal karbon-karbon.
Saya akan menjawab permasalahan no 1. Salah satu reaksi yang paling penting dari enolat adalah alkilasi oleh adanya perlakuan dengan alkil halida. Reaksi ini sangat berguna untuk tujuan sintesis karena memungkinkan pembentukan ikatan karbon-karbon baru, yaitu menggabungkan dua senyawa yang lebih kecil menjadi molekul yang lebih besar. Alkilasi terjadi bila anion enolat yang nukleofilik bereaksi dengan alkil halida yang elektrofilik dan memaksa keluar ‘leaving group’ melalui mekanisme SN2. Reaksi dapat terjadi pada atom oksigen enolat atau karbon alfa, tetapi secara normal terjadi pada atom karbon.
ReplyDelete