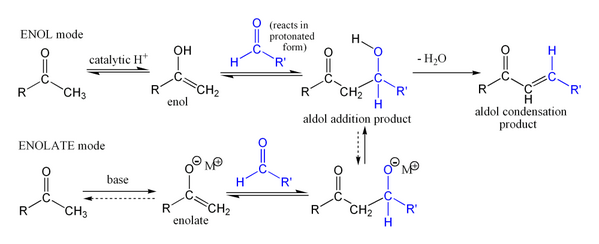
Stereochemical Considering in Planning Synthesis
(Pertimbangan Stereokimia dalam Merancang Sintesis)
Retrosintesis adalah proses pembelahan molekul target sintesis menuju ke material start yang tersedia melalui serangkaian pemutusan ikatan (diskoneksi) dan perubahan gugus fungsi atau interkonversi gugus fungsional (IGF). Analisis retrosintetis adalah teknik pemecahan masalah dalam merencanakan sintesis organik. Analisis retrosintesis hanya akan berhasil jika di arahkan ke suatu tujuan tertentu. Tujuan dasarnya adalah untuk menghasilkan prekursor yang bertanggung jawab terhadap ketersediaan starting material. Namun, tujuan ini bisa digunakan sebagai dasar pedoman hanya ketika starting material yang mungkin, bisa diidentifikasi dari struktur target. Secara umum, starting material tidak akan diperoleh dengan mudah jika senyawa targetnya sangat kompleks ( dan oleh karena itulah digunakan retrosintesis analisi ). Tujuan dasar, kemudian, menjadi penghasilan prekursor yang akan lebih mudah dalam mensintesis dibandingkan target awalnya. Analisis retrosintesis ini diarahkan untuk penyederhanaan molekular. Corey telah memformulasikan 5 jenis strategi utama yang mengarah pada penyederhanaan tsb.
1. functional-group based strategy
Gugus fungsi dalam suatu struktur target mampu mengarahkan pencarian transformasi dalam beberapa cara :
- Removal of reactive and masked functionality
- diskoneksi berdasarkan letak gugus fungsi
- rekoneksi gugus fungsi untuk membentuk cincin secara retrosintesis
Strategi rekonnektif terhalang oleh aturan strategik.
2. Topological strategy
Diskoneksi dari spesifik, juga disebut dengan ' strategic' bonds mampu menyebbakan terjadihanya penyederhaan molekular utama. ada 7 jenis strategic bonds. ikatan dalam sistem cincin polisiklik, ikatan dalam sistem cincin polifused, pasangan ikatan dalam sistem cincin, ikatan yang menghubungkan rantai ke cincin, ikatan yang menghubungkan rantai ke rantai lain, dan ikatan yang menghubungkan rantai ke gugus funsgi
3. Structure-based strategy
A very useful guidance for retrosynthetic analysis can be provided by the application of a powerfully simplifying transform -- corresponding to a reaction effecting a considerable increase in complexity. Very often such an application is suggested by the presence of (functionalized) rings of specific sizes in the target molecule. Some powerfully simplifying transforms are:
- Diels-Alder
- Hetero Diels-Alder
- Robinson annulation
- Birch reduction
- Internal ene reaction
- Halolactonization
4. Structure-goal strategy
5. Stereochemical strategy
Pada strategi ini fokusnya adalah pada penghulangan stereocenter di bawah streokontrol. Steeokontrol bisa diperoleh melalui kontrol mekanisme maupun kontrol substrat. Rekoneksi yang memindahkan stereocenter dari rantai (dimana di situ sulit untuk terjadi interaksi) ke cincin (lebih mudah) juga bisa dipertimbangkan sebagai salah satu strategi stereokimia.
Kontrol pertimbangan stereokimia dalam metode sintesis, contohnya pada senyawa cincin, stereoselektifitas biasanya dapat diprediksi pada analisis konformasional dasar dari reaktan dan mempertimbangkan faktor sterik dan stereoelektronik yang bisa mempengaruhi reagen. Dalam sintesis stereoselektif suatu material kiral dalam bentuk rasemat, dibutuhkan untuk melakukan kontrol dari konfigurasi relatif semua pusat stereogenik. Jadi, dalam merencanakan suatu sintesis, hasil stereokimia semua reaksi yang membentuk ikatan rangkap baru, cincin terkonjugasi, dan pusat kiral, harus saling bekerja sama dalam merencanakan suatu sintesis.
Dalam suatu sintesis stereoselektif, masing - masing pusat berurutan diperkenalkan dalam hubungannya dengan stereocenter yang ada. Kondisi ini biasanya sangat sulit dicapai. Ketika suatu reaksi tidak seutuhnya bersifat stereoselektif, produk akan mengandung satu atau lebih diastereomer pada produk yang diingikan. Hal ini membutuhkan baik itu pemurnian atau manipulasi untuk memperoleh stereokimia yang benar. Beruntungnya, diastereomer biasanya mudah untuk dipisahkan, tetapi efisiensi suatu sintesis akan berkurang denngan adanya separasi tsb. Jadi, kestereoselektifitasan yang tinggi merupakan suatu tujuan penting dalam perencanaan sintesis.
Jika suatu senyawa ingin diperoleh dalam bentuk murni secara enansiomer, maka suatu sintesis enansioselektif harus dikembangkan.
Ada 4 pendekatan umum yang digunakan untuk memperolehnya.
A. Berdasarkan pada penggabungan suatu resolusi ke dalam rencana sintesis.
Pendekatan ini melibatkan penggunaan rasemat atau strting material akiral dan kemudian memecahkan suatu intermediet dalam sintesis. Dalam sintesis berdasarkan resolusi, ada 2 kriteria yg harus dipenuhi : (1) harus tidak mengganggu konfigurasi pada pusat stereokimia, dan (2) pusat stereogenik baru harus diperkena;lan dengan konfigurasi relatif yang benar ke pusat yg ada.
B. Penggunaan stating material yang murni secara enansiomer.
Ada banyak sekali material atau substansi yang secara alami diperoleh dari nya, yang tersedia dalam bentuk murni secara ennasiomer. DImana, suatu sintesis yang sangat stereoselektif harus mampu mengontrol stereokimia dari semua pusat stereogeik baru sehingga memiliki hubungan dengan pusat kiral yg ada pada starting material. Ketika hal ini tdk bisa diperoleh, maka stereoisomer yang didapat harus dipisahkan dan dimurnikan
C. Melibatkan penggunaan jumlah stoikimetri dari chiral auxiliary
D. Menggunakan katalis kiral dalam reaksi.
Yang mana penggunaan ini akan menciptakan satu atau lebih stereocenter. Jika katalis beroperasi dengan efisiensi sempurna, maka material yang murni secara enansiomer akan diperoleh. Tahap lanjutan harus mengontrol konfigurasi relatif dari pusat kiral baru.
Dalam prakteknya, keempat pendekatan ini sangatlah efektif dalam sintesis nya. Jika dilakukan perbandingan berdasarkan efisiensi absolut dalam penggunaan material kiral , maka : resolusi < sumber alami < chiral auxiliary < katalis. Proses resolusi hanya menggunakan setengah dari material rasemik awal. Starting material daro sumber alami bisa digunakan dengan efisiensi 100%. Tapi hanya bisa satu kali pakai dan tidak bisa digunakan kembali. Suatu chiral auxiliary bisa di dapatkan kembali dan digunakan kembali, tetapi harus digunakan dalam jumlah stoikiometri. Sedangkan katalis kiral bisa menghasilkan jumlah tak terbatas dari material yang murni secara nenasiomer.
Apapun jalur mekanisme secar detilnya, perencanaan sintesis harus melibatkan kontrol stereokimia. Ketika hal ini tidak bisa dilakukan, maka harga yang harus dibayar adalah, pemisahan stereoisomer dan penghasilan reduksi pada keselurhan yieldnya.
7.1 Retrosynthetic Strategies
Strategi retrosintetik dibutuhkan karena pemilihan bahan dasar (starting material) untuk reaksi sintesis didasarkan pada reaksi retrosintetik tersebut sekaligus sebagai strategi atau pemandu dalam melakukan reaksi sintesis.
Analisis retrosintetik hanya akan menghasilkan hasil yang bermanfaat jika diarahkan ke beberapa tujuan. Tujuan dasarnya adalah untuk menghasilkan prekursor yang sesuai dengan bahan awal yang tersedia. Kemudian, diarahkan menjadi generasi prekursor yang lebih mudah disintesis daripada target awal; prekursor tersebut cenderung lebih dekat dengan senyawa yang tersedia daripada target awal. Analisis retrosintetik diarahkan untuk penyederhanaan molekuler. Corey telah merumuskan lima jenis strategi utama yang mengarah pada penyederhanaan yang diinginkan yaitu :
1. Functional-group based strategies (strategi berdasarkan gugus fungsi)
2. Topological strategies (strategi berdasarkan topologi)
3. Transform-based strategies (strategi berdasarkan transformasi)
4. Structure-goal strategies (strategi berdasarkan struktur tujuan)
5. Stereochemical strategies (strategi berdasarkan stereokimia)
Stereochemical strategies berfokus pada penghapusan stereocenters (pusat stereokimia) dibawah stereocontrol (kontrol stereokimia). Stereocontrol dapat dicapai melalui kontrol mekanistik atau kontrol substrat. Rekoneksi dilakukan untuk memindahkan stereocenter dari rantai alifatik (sulit untuk diperkenalkan) ke dalam cincin (jauh lebih mudah dikenali).
7.2 Approaches to Planning Practical Organic Syntheses
Permasalahan dalam sintesis pada dasarnya adalah masalah dalam desain dan perencanaan. Mengingat sintesis hanya menghasilkan 1 senyawa organik tertentu, dimana senyawa target telah didefinisikan secara tepat, baik sebagai struktur maupun stereokimia. Maka selalu ada berbagai cara agar tujuan tersebut dapat dicapai yaitu melalui penggunaan bahan awal yang sama atau yang berbeda.
A. Methodology (Metode)
Metodologi umum dalam perencanaan sintesis melibatkan dua langkah, yaitu (1) Mempertimbangkan berbagai cara yang memungkinkan kerangka karbon yang diinginkan dapat dibangun, baik dari molekul yang lebih kecil atau oleh perubahan pada beberapa kerangka yang ada. (2) Mempertimbangkan pembentukan gugus fungsi yang diinginkan pada rangka karbon yang diinginkan juga. Dalam
banyak kasus, gugus fungsi yang diinginkan dapat dihasilkan sebagai konsekuensi dari reaksi dimana kerangka yang diinginkan itu sendiri dihasilkan.
banyak kasus, gugus fungsi yang diinginkan dapat dihasilkan sebagai konsekuensi dari reaksi dimana kerangka yang diinginkan itu sendiri dihasilkan.
Pilihan rute terbaik biasanya dibuat dengan mempertimbangkan :
1. Ketersediaan bahan awal
2. Kesederhanaan berbagai langkah dan skala sintesis
3. Jumlah langkah pemisahan yang terlibat
4. Hasil dari setiap langkah
5. Kemudahan pemisahan dan pemurnian produk yang diinginkan dari produk samping dan stereoisomernya.
B. Starting Materials (Bahan dasar)
Bahan awal organik termurah yang tersedia adalah metana, etena, etin, propena, butena, benzena, dan metilbenzena (toluena). Banyak bahan kimia yang dapat disiapkan dengan mudah dan hasil yang tinggi dari salah satu hidrokarbon tersebut. Alasan lainnya karena relatif tidak mahal dan banyak tersedia.
7.3 Some Principles in Control of Stereochemistry
Stereokontrol untuk cincin sikloheksana dalam kimia organik sebagian besar difokuskan pada posisi preferensial aksial/ekuatorial substituen pada cincin. Stereokontrol makrosiklik difokuskan pada pemodelan substitusi dan reaksi dari cincin dalam kimia organik, dimana unsur-unsur stereogenik jarak jauh memberikan pengaruh konformasi yang cukup untuk mengarahkan hasil reaksi.
Dalam reaksi stereokimia, jika terdapat diastereomer maka sebaiknya dipisahkan terlebih dahulu sebelum dilakukan tahapan reaksi berikutnya agar produk reaksi menjadi 96% enantiomer saja atau maksudnya untuk mengurangi keberadaan enantiomer baru dari diastereomer produk asli. Hal ini menunjukkan betapa pentingnya memisahkan diastereomer itu sehingga diastereomer bisa menjadi 0% dan enantiomer produk asli menjadi optimum.
7.4 Problem of substituents and stereoisomers
Situasi menjadi kompleks ketika kemungkinan isomer yang tidak diinginkan akan dihasilkan juga pada langkah-langkah sintesis yang berbeda. Reaksi yang menghasilkan isomer tunggal (reaksi diastereospesifik) dalam hasil yang baik lebih disukai. Beberapa reaksi seperti Diels-Alder menghasilkan beberapa stereopoint (titik dimana stereoisomer dihasilkan) secara bersamaan dalam satu langkah dengan cara yang sangat dapat diprediksi. Namun, senyawa murni pada step terakhir reaksi biasanya masih memiliki 50% enansiomer yang tidak diinginkan, sehingga dapat menyebabkan penurunan drastis dalam efisiensi rute. Sehingga diinginkan untuk memisahkan isomer optik sedini mungkin sepanjang rute sintetis. Caranya dengan Chiron Approach, dimana bahan awal yang tepat dipilih dari 'kolam kiral' yang tersedia dengan mudah.
problema..
1. Jika suatu senyawa ingin diperoleh dalam bentuk murni secara enansiomer, maka suatu sintesis enansioselektif harus dikembangkan.
Ada 4 pendekatan umum yang digunakan untuk memperolehnya.
Ada 4 pendekatan umum yang digunakan untuk memperolehnya.
apakah dari 4 pendekatan ini harus dilakukan semua atau hanya disesuaikan saja ?
2. Analisis retrosintetik hanya akan menghasilkan hasil yang bermanfaat jika diarahkan ke beberapa tujuan. bagaimana mengarahkannya ?
3. bagaimana melakukan Kontrol pertimbangan stereokimia dalam metode sintesis?
3. bagaimana melakukan Kontrol pertimbangan stereokimia dalam metode sintesis?